Hàng trăm nhà khoa học đã nghiên cứu về vắc-xin mRNA trong hàng thập kỷ trước khi đại dịch do virus corona bùng phát.
Cuối năm 1987, Robert Malone đã thực hiện một thí nghiệm mang tính bước ngoặt. Ông trộn các đoạn RNA thông tin với các giọt chất béo để tạo ra một loại kiểu nồi hầm phân tử. Các tế bào của con người được tắm trong nồi hầm di truyền này đã hấp thụ mRNA và bắt đầu sản xuất protein từ nó.
Nhận thấy rằng khám phá này có thể có tiềm năng sâu rộng trong y học, Malone, một nghiên cứu sinh tại Viện Nghiên cứu Sinh học Salk ở La Jolla, California, sau đó đã ghi lại một số ghi chú, mà trong đó ông đã ký tên và ghi ngày tháng. Ông đã viết vào ngày 11 tháng 1 năm 1988, nếu tế bào có thể tạo ra protein từ mRNA được đưa vào chúng thì có thể “coi RNA như một loại thuốc”. Một thành viên khác của phòng thí nghiệm Salk cũng đã ký vào các ghi chú để lưu lại hậu thế. Cuối năm đó, các thí nghiệm của Malone cho thấy phôi của ếch hấp thụ những mRNA như vậy. Đây là lần đầu tiên có người sử dụng các giọt chất béo để dễ dàng đưa mRNA vào một cơ thể sống.
Những thí nghiệm đó là bước đệm để hướng tới hai trong số những vắc-xin quan trọng và có lợi nhất trong lịch sử: vắc-xin COVID-19 dựa trên mRNA được cung cấp cho hàng trăm triệu người trên thế giới. Doanh thu toàn cầu của những sản phẩm này dự kiến sẽ đạt 50 tỷ đô la Mỹ chỉ riêng vào năm 2021.
Nhưng con đường dẫn đến thành công không phải là một đường thẳng. Trong nhiều năm sau các thí nghiệm của Malone, mà chính họ cũng đã rút ra từ công trình của các nhà nghiên cứu khác, mRNA được coi là quá không ổn định và đắt đỏ để được sử dụng như một loại thuốc hoặc vắc-xin. Hàng chục phòng thí nghiệm học thuật và các công ty đã làm việc với ý tưởng này, vật lộn với việc tìm ra công thức phù hợp của chất béo và axit nucleic – những thành phần cơ bản của vắc-xin mRNA.
Các mũi tiêm mRNA ngày nay có những cải tiến được phát minh nhiều năm sau khi Malone làm thí nghiệm ban đầu, bao gồm RNA được sửa đổi về mặt hóa học và các giọt chất béo khác nhau để đưa chúng vào tế bào. Tuy nhiên, Malone, người tự gọi mình là “nhà phát minh ra vắc-xin mRNA”, cho rằng công việc của mình chưa được ghi nhận đầy đủ. “Tôi đã được viết nên lịch sử”, ông nói với Nature.
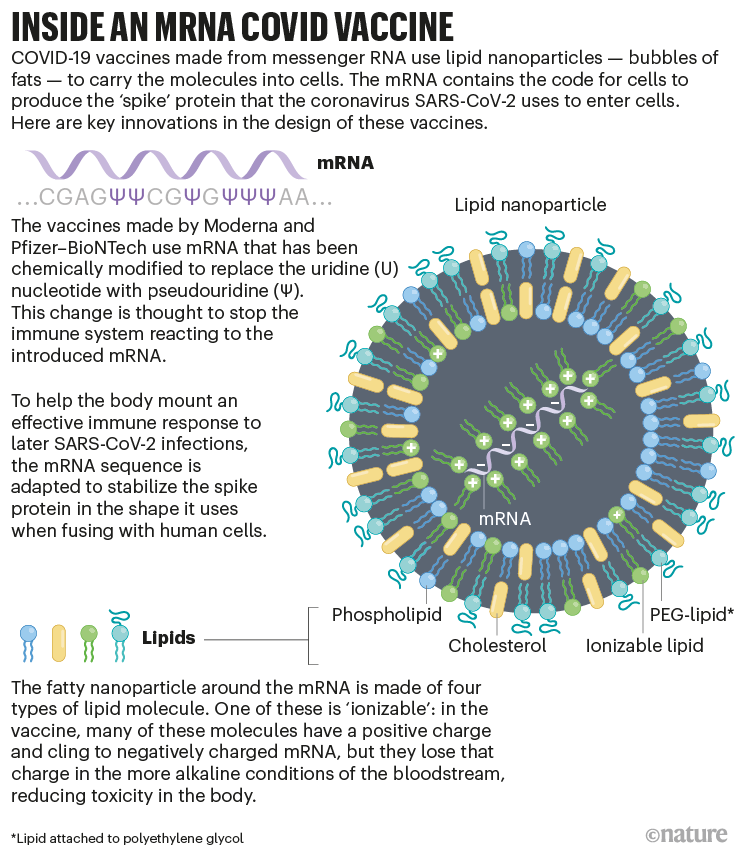
Vắc-xin COVID-19 được sản xuất từ mRNA sử dụng hạt nano lipid – các giọt chất béo – để vận chuyển phân tử này vào trong tế bào. mRNA chứa mã di truyền để tế bào sản xuất protein gai mà virus SARS-CoV-2 sử dụng để thâm nhập tế bào. Dưới đây là những cải tiến quan trọng trong thiết kế của những vắc-xin này.
Vắc-xin được sản xuất bởi Moderna và Pfizer-BioNTech sử dụng mRNA đã được biến đổi về mặt hóa học để thay thế uridine (U) bằng pseudouridine (Ψ). Sự thay đổi này được cho là ngăn hệ miễn dịch phản ứng với việc tiêm mRNA vào cơ thể.
Để giúp cơ thể sản sinh một đáp ứng miễn dịch hiệu quả nếu sau đó nhiễm SARS-CoV-2, chuỗi mRNA đã được điều chỉnh để ổn định protein gai vào hình dạng mà virus sử dụng khi thâm nhập vào tế bào người.
Hạt nano lipid quanh mRNA được tạo ra bởi bốn loại phân tử lipid. Một trong số đó là ‘có thể ion hóa’: trong vắc-xin, những phân tử này có điện tích dương và liên kết với mRNA điện tích âm, nhưng chúng mất điện tích này trong môi trường có tính kiềm hơn nhưng trong máu, làm giảm tính độc đối với cơ thể.
Cuộc tranh luận xem ai xứng đáng được công nhận vì đã đi tiên phong trong công nghệ này đang nóng lên khi các giải thưởng bắt đầu được trao – và những đồn đoán ngày càng trở nên gay gắt hơn trước khi giải Nobel được công bố vào tháng tới. Nhưng các giải thưởng chính thức chỉ giới hạn cho một số nhà khoa học, nó sẽ không công nhận rất nhiều người đã đóng góp cho sự phát triển y học của mRNA. Trên thực tế, con đường tạo ra vắc-xin mRNA được dựa trên công việc của hàng trăm nhà nghiên cứu trong hơn 30 năm.
Câu chuyện này làm sáng tỏ cách mà nhiều khám phá khoa học trở thành phát kiến thay đổi cuộc sống: với hàng thập kỷ đi vào ngõ cụt, bị từ chối và cuộc chiến tranh giành lợi nhuận tiềm năng, nhưng cũng là sự hào phóng, tò mò và kiên trì chống lại sự hoài nghi. Paul Krieg, một nhà sinh học phát triển tại Đại học Arizona ở Tucson, người đã đóng góp vào giữa những năm 1980, cho biết: “Đó là một chuỗi các bước và bạn không bao giờ biết điều gì sẽ trở nên hữu ích”.
Sự khởi đầu của mRNA
Các thí nghiệm của Malone không phải tự dưng xuất hiện. Từ năm 1978, các nhà khoa học đã sử dụng các cấu trúc màng chất béo được gọi là liposome để vận chuyển mRNA vào tế bào chuột và người để thúc đẩy biểu hiện protein. Các liposome đóng gói và bảo vệ mRNA, sau đó kết hợp với màng tế bào để đưa vật liệu di truyền vào tế bào. Bản thân những thí nghiệm này được xây dựng dựa trên nhiều năm làm việc với liposome và với mRNA; cả hai đều được phát hiện vào những năm 1960.
Một chuỗi dài các tiến bộ khoa học đã dẫn đến những vắc-xin mRNA đầu tiên, được ra mắt năm ngoái nhằm bảo vệ con người khỏi COVID-19. Những vắc-xin này, cũng như các thuốc mRNA, tận dụng sự phát triển trong khoa học về mRNA và các hệ thống phân phối, dựa trên các phân tử lipid.
| 1960 | mRNA
phát hiện mRNA |
Hệ thống phân phối dựa trên lipid | mRNA và lipid (cho vắc-xin) | |
| 1965 | Những protein đầu tiên được sản xuất từ mRNA phân lập trong phòng thí nghiệm | Liposome đầu tiên (giọt chất béo, gồm các phân tử lipid) được sản xuất | ||
| 1970 | Liposome được sử dụng để phân phối thuốc
Liposome được sử dụng để phân phối vắc-xin |
|||
| 1975 | mRNA trong liposome đầu tiên được đưa vào tế bào | |||
| 1980 | mRNA được tổng hợp trong phòng thí nghiệm | |||
| 1985 | mRNA tổng hợp trong liposome tích điện dương (cấu trúc được tạo nên bởi lipid tích điện dương) được đưa vào tế bào người, phôi ếch | |||
| 1990 | mRNA được thử nghiệm làm thuốc điều trị (trên chuột) | mRNA trong liposome được đưa vào chuột
vắc-xin mRNA đầu tiên được thử nghiệm (phòng cúm, trên chuột) |
||
| 1995 | mRNA được thử nghiệm như vắc-xin ung thư (trên chuột) | Công ty đầu tiên tập trung vào mRNA được thành lập (Merix Biosciences, sau đổi thành Argos, và hiện là Colmmune) | ||
| 2000 | Hạt nano lipid 4 thành phần đầu tiên (vào thời điểm đó là để phân phối DNA) | CureVac được thành lập | ||
| 2005 | Khám phá ra rằng RNA được chỉnh sửa có thể tránh được hệ miễn dịch | Phương pháp sản xuất hạt nano lipid có thể được mở rộng quy mô | BioNTech được thành lập. Novartis và Shire thành lập bộ phận mRNA | |
| 2010 | Thử nghiệm lâm sàng đầu tiên của vắc-xin mRNA cho bệnh truyền nhiễm (bệnh dại) | Vắc-xin mRNA đầu tiên trong hạt nano lipid được thử nghiệm trên chuột | Moderna được thành lập
Cơ quan Dự án Nghiên cứu Tiên tiến Quốc phòng Hoa Kỳ bắt đầu tài trợ nghiên cứu vắc-xin mRNA |
|
| 2015 | Thuốc với hạt nano lipid đầu tiên (patisiran) được phê duyệt | Vắc-xin mRNA trong hạt nano lipid đầu tiên được thử nghiệm lâm sàng (phòng cúm) | ||
| 2020 | Vắc-xin COVID-19 dựa trên mRNA được cấp phép sử dụng khẩn cấp |
Tuy nhiên, vào thời đó, chỉ có một vài nhà nghiên cứu suy nghĩ về mRNA như một sản phẩm y tế – đặc biệt là vì vẫn chưa có cách sản xuất vật liệu di truyền này trong phòng thí nghiệm. Thay vào đó, họ hy vọng sử dụng nó để tìm hiểu các quá trình phân tử cơ bản. Hầu hết các nhà khoa học sử dụng mRNA từ máu thỏ, tế bào chuột nuôi cấy hoặc một số nguồn động vật khác.
Điều đó đã thay đổi vào năm 1984, khi Krieg và các thành viên khác của một nhóm do nhà sinh học phát triển Douglas Melton và các nhà sinh học phân tử Tom Maniatis và Michael Green tại Đại học Harvard ở Cambridge, Massachusetts, dẫn đầu, sử dụng một loại enzyme tổng hợp RNA (lấy từ virus) và các công cụ khác để tạo ra mRNA có hoạt tính sinh học trong phòng thí nghiệm – một phương pháp cốt lõi vẫn được sử dụng cho đến ngày nay. Krieg sau đó đã tiêm loại mRNA tạo ra trong phòng thí nghiệm này vào trứng ếch và cho thấy nó hoạt động như RNA từ động vật.
Cả Melton và Krieg đều nói rằng họ xem mRNA tổng hợp chủ yếu là một công cụ nghiên cứu để nghiên cứu chức năng và hoạt động của gen. Năm 1987, sau khi Melton phát hiện ra rằng mRNA có thể được sử dụng cả để kích thích và ngăn chặn sản xuất protein, ông đã giúp thành lập một công ty có tên Oligogen (sau này đổi tên thành Gilead Sciences ở Foster City, California) để khám phá các cách sử dụng RNA tổng hợp để ngăn chặn sự biểu hiện của các gen mục tiêu – nhằm điều trị bệnh. Mọi trong phòng thí nghiệm hoặc cộng tác viên của họ đều không nghĩ đến vắc-xin.

Krieg nói: “RNA nói chung có tiếng là không ổn định không thể tin nổi. Mọi thứ xung quanh RNA đều được bao bọc cẩn thận.” Điều đó có thể giải thích tại sao văn phòng phát triển công nghệ của Harvard đã chọn không cấp bằng sáng chế cho phương pháp tổng hợp RNA của nhóm. Thay vào đó, các nhà nghiên cứu Harvard chỉ cần đưa các hợp chất của họ cho Promega Corporation, một công ty cung cấp vật tư phòng thí nghiệm ở Madison, Wisconsin, nơi cung cấp các công cụ tổng hợp RNA cho các nhà nghiên cứu. Họ nhận được tiền bản quyền khiêm tốn và đổi lại là một hộp rượu Champagne Veuve Clicquot.
Tranh chấp bằng sáng chế
Nhiều năm sau, Malone làm theo chiến thuật của nhóm Harvard để tổng hợp mRNA cho các thí nghiệm của mình. Nhưng ông đã thêm một loại liposome mới, một loại mang điện tích dương, giúp tăng cường khả năng tương tác của vật liệu với mRNA mang điện tích âm. Những liposome này được phát triển bởi Philip Felgner, một nhà hóa sinh học, hiện là lãnh đạo Trung tâm Nghiên cứu và Phát triển Vắc-xin tại Đại học California, Irvine.

Mặc dù đã thành công khi sử dụng liposome để đưa mRNA vào tế bào người và phôi ếch, Malone chưa bao giờ lấy được bằng tiến sĩ. Ông đã bất hòa với cố vấn của mình, nhà nghiên cứu liệu pháp gen Salk, Inder Verma, và vào năm 1989, ông bỏ các nghiên cứu sau đại học để làm việc cho Felgner tại Vical, một công ty mới thành lập ở San Diego, California. Tại đó, họ và các cộng tác viên tại Đại học Wisconsin-Madison đã chỉ ra rằng phức hợp lipid-mRNA có thể thúc đẩy sản xuất protein ở chuột.

Sau đó, mọi thứ trở nên lộn xộn. Cả Vical (với Đại học Wisconsin) và Salk đều bắt đầu nộp đơn xin cấp bằng sáng chế vào tháng 3 năm 1989. Nhưng Salk sớm từ bỏ yêu cầu cấp bằng sáng chế của mình, và vào năm 1990, Verma gia nhập ban cố vấn của Vical.
Malone cho rằng Verma và Vical đã thực hiện một thỏa thuận ngầm để tài sản trí tuệ liên quan được chuyển cho Vical. Malone được liệt vào danh sách nhà phát minh cùng một vài người nữa, nhưng ông không còn kiếm lợi nhuận cá nhân từ các hợp đồng được ký sau đó, như ông đáng lẽ sẽ có có từ bất kỳ bằng sáng chế nào do Salk cấp. Kết luận của Malone: “Họ trở nên giàu có nhờ sản phẩm trí tuệ của tôi.”
Verma và Felgner kiên quyết phủ nhận các cáo buộc của Malone. “Đó là điều hoàn toàn vô nghĩa,” Verma nói với Nature. Ông nói rằng quyết định từ bỏ đơn đăng ký bằng sáng chế thuộc về văn phòng chuyển giao công nghệ của Salk. (Verma đã từ chức tại Salk vào năm 2018, sau những cáo buộc quấy rối tình dục, mà ông ta tiếp tục phủ nhận.)
Malone rời Vical vào tháng 8 năm 1989, với lý do bất đồng với Felgner về “đánh giá khoa học” và “sự công nhận cho những đóng góp trí tuệ của tôi”. Ông đã tốt nghiệp trường y khoa và thực hiện một năm đào tạo lâm sàng trước khi làm việc trong học viện, nơi ông cố gắng tiếp tục nghiên cứu về vắc-xin mRNA nhưng phải vật lộn để đảm bảo nguồn tài trợ. (Ví dụ, vào năm 1996, ông đã không thành công khi nộp đơn cho một cơ quan nghiên cứu bang California để xin trợ cấp phát triển một loại vắc-xin mRNA phòng chống nhiễm coronavirus theo mùa.) Thay vào đó, Malone tập trung vào vắc-xin DNA và công nghệ phân phối.
Năm 2001, ông chuyển sang công việc thương mại và tư vấn. Và trong vài tháng qua, ông đã bắt đầu công khai công kích tính an toàn của vắc-xin mRNA mà nghiên cứu của ông đã giúp phát triển. Ví dụ, Malone nói rằng các protein được tạo ra bởi vắc-xin có thể làm hỏng các tế bào của cơ thể và rủi ro của việc tiêm chủng lớn hơn lợi ích đối với trẻ em và thanh thiếu niên – tuyên bố rằng các nhà khoa học khác và quan chức y tế đã nhiều lần bác bỏ.
Thách thức sản xuất
Năm 1991, Vical tham gia một hợp tác nghiên cứu trị giá hàng triệu đô la và thỏa thuận cấp phép với công ty Merck của Mỹ, một trong những nhà phát triển vắc-xin lớn nhất thế giới. Các nhà khoa học của Merck đã đánh giá công nghệ mRNA trên chuột với mục đích tạo ra vắc-xin cúm, nhưng sau đó đã từ bỏ cách tiếp cận đó. Jeffrey Ulmer, một nhà khoa học trước đây của Merck, người hiện đang tư vấn cho các công ty về các vấn đề nghiên cứu vắc-xin cho biết: “Chi phí và tính khả thi của việc sản xuất đã khiến chúng tôi tạm dừng.”
Các nhà nghiên cứu tại một công ty công nghệ sinh học nhỏ ở Strasbourg, Pháp, có tên là Transgène, cũng cảm thấy như vậy. Ở đó, vào năm 1993, một nhóm do Pierre Meulien dẫn đầu, làm việc với các đối tác công nghiệp và học thuật, là người đầu tiên chỉ ra rằng mRNA trong liposome có thể tạo ra một đáp ứng miễn dịch kháng virus đặc hiệu ở chuột. (Một tiến bộ thú vị khác đã đến vào năm 1992, khi các nhà khoa học tại Viện Nghiên cứu Scripps ở La Jolla sử dụng mRNA để thay thế một loại protein bị thiếu hụt ở chuột, để điều trị một chứng rối loạn chuyển hóa. Nhưng phải mất thêm gần hai thập niên thì các phòng thí nghiệm độc lập mới báo cáo thành công tương tự.)
Các nhà nghiên cứu Transgène đã xin cấp bằng sáng chế cho phát minh của họ và tiếp tục nghiên cứu vắc-xin mRNA. Nhưng Meulien, hiện là người đứng đầu Innovative Medicines Initiative, một doanh nghiệp tư nhân có trụ sở tại Brussels, ước tính rằng ông cần ít nhất 100 triệu euro (119 triệu đô la Mỹ) để tối ưu hóa nền tảng – và ông không định yêu cầu ông chủ của mình chi nhiều tiền như vậy cho một công việc mạo hiểm “khó khăn, rủi ro cao” như vậy. Bằng sáng chế hết hiệu lực sau khi công ty mẹ của Transgène quyết định ngừng trả các khoản phí cần thiết để duy trì.
Nhóm của Meulien, giống như nhóm của Merck, thay vào đó tập trung vào vắc-xin DNA và các hệ thống phân phối dựa trên vectơ khác. Nền tảng DNA cuối cùng đã mang lại một số vắc-xin được cấp phép cho các ứng dụng trong thú y – chẳng hạn như giúp ngăn ngừa nhiễm trùng trong các trang trại cá. Và mới tháng trước, các cơ quan quản lý ở Ấn Độ đã phê duyệt khẩn cấp vắc-xin DNA đầu tiên trên thế giới dùng cho con người để giúp ngăn chặn COVID-19. Nhưng vì những lý do chưa được hiểu rõ ràng, vắc-xin DNA thành công ở người khá muộn.
Tuy nhiên, Ulmer lập luận nỗ lực phối hợp của ngành này quanh công nghệ DNA cũng mang lại lợi ích cho vắc-xin RNA. Từ việc cân nhắc sản xuất và kinh nghiệm điều phối cho đến thiết kế trình tự và kiến thức về phân tử, “nhiều điều chúng tôi học được từ DNA có thể được áp dụng trực tiếp cho RNA”, ông nói. “Nó cung cấp nền tảng cho sự thành công của RNA.”
Sự đấu tranh liên tục
Trong những năm 1990 và trong hầu hết những năm 2000, gần như mọi công ty vắc-xin cân nhắc làm việc với mRNA đều lựa chọn đầu tư nguồn lực của mình vào nơi khác. Hiểu biết thông thường cho thấy rằng mRNA quá dễ bị phân hủy và việc sản xuất nó quá tốn kém. Peter Liljeström, nhà virus học tại Viện Karolinska ở Stockholm, nói: “Đó là một cuộc đấu tranh liên tục”. Ông là người đã tiên phong trong nghiên cứu một loại vắc-xin RNA tự nhân bản vào 30 năm trước.
Matt Winkler, người sáng lập một trong những công ty cung cấp vật tư phòng thí nghiệm chuyên về RNA đầu tiên, Ambion, ở Austin, Texas, nói năm 1989: “Rất khó làm việc với RNA. Nếu khi đó bạn hỏi lại tôi liệu có thể tiêm RNA vào ai đó để làm vắc-xin không, tôi sẽ cười vào mặt bạn.”
Ý tưởng vắc-xin mRNA đã được tiếp nhận tốt hơn trong giới ung thư học, mặc dù như một tác nhân điều trị chứ không phải là để ngăn ngừa bệnh tật. Bắt đầu với công việc của nhà trị liệu gen David Curiel, một số nhà khoa học hàn lâm và các công ty mới thành lập đã tìm hiểu xem liệu mRNA có thể được sử dụng để chống lại ung thư hay không. Nếu các protein mã hóa mRNA được biểu hiện bởi các tế bào ung thư, thì việc tiêm nó vào cơ thể có thể huấn luyện hệ miễn dịch để tấn công các tế bào đó.
Curiel, hiện đang làm việc tại Trường Y Đại học Washington ở St Louis, Missouri, đã có một số thành công trên chuột. Nhưng khi ông tiếp cận Ambion về các cơ hội thương mại hóa, công ty này đã nói với ông rằng: “Chúng tôi không thấy bất kỳ tiềm năng kinh tế nào trong công nghệ này”.
Một nhà miễn dịch học ung thư khác đã thành công hơn, dẫn đến việc thành lập công ty điều trị mRNA đầu tiên vào năm 1997. Eli Gilboa đề xuất lấy các tế bào miễn dịch từ máu và khiến chúng hấp thụ mRNA tổng hợp mã hóa các protein khối u. Sau đó, các tế bào này sẽ được tiêm trở lại cơ thể, nơi chúng có thể điều khiển hệ miễn dịch tấn công các khối u đang ẩn nấp.
Gilboa và các đồng nghiệp của ông tại Trung tâm Y tế Đại học Duke ở Durham, Bắc Carolina, đã chứng minh điều này trên chuột. Đến cuối những năm 1990, các cộng tác viên học thuật đã khởi động các thử nghiệm trên người và sản phẩm thương mại của Gilboa, Merix Bioscience (sau đó được đổi tên thành Argos Therapeutics và hiện nay được gọi là CoImmune), ngay sau đó là các nghiên cứu lâm sàng của riêng họ. Cách tiếp cận này có vẻ hứa hẹn cho đến một vài năm trước, khi một loại vắc-xin ứng cử viên giai đoạn cuối thất bại trong một cuộc thử nghiệm lớn; nó bây giờ phần lớn đã không còn hợp thời nữa.
Nhưng công việc của Gilboa có một kết quả quan trọng. Nó đã truyền cảm hứng cho những người sáng lập của các công ty Đức là CureVac và BioNTech – hai trong số các công ty mRNA lớn nhất hiện nay – bắt đầu nghiên cứu mRNA. Cả Ingmar Hoerr, tại CureVac, và Uğur Şahin, tại BioNTech, nói với Nature rằng, sau khi biết những gì Gilboa đã làm, họ cũng muốn làm điều tương tự, nhưng bằng cách đưa mRNA trực tiếp vào cơ thể.

Người thúc đẩy các công ty mới thành lập
Hoerr là người đầu tiên đạt được thành công. Khi còn ở Đại học Tübingen ở Đức, ông đã báo cáo vào năm 2000 rằng tiêm trực tiếp RNA có thể tạo ra đáp ứng miễn dịch ở chuột. Ông đã lập nên CureVac (cũng có trụ sở tại Tübingen) vào năm đó. Nhưng có vẻ ít nhà khoa học hoặc nhà đầu tư quan tâm. Tại một hội nghị, nơi Hoerr trình bày dữ liệu ban đầu trên chuột, ông nói, “có một người đoạt giải Nobel đứng lên từ hàng đầu tiên và nói rằng, ‘những gì anh đang nói với chúng tôi ở đây hoàn toàn là điều vớ vẩn”. (Hoerr từ chối nêu tên người đoạt giải Nobel đó.)
Cuối cùng, tiền cũng đổ về. Và trong vài năm, thử nghiệm trên người đã bắt đầu. Giám đốc khoa học của công ty vào thời điểm đó, Steve Pascolo, là đối tượng nghiên cứu đầu tiên: ông đã tự tiêm mRNA cho mình và vẫn có những vết sẹo trắng cỡ bằng que diêm ở cẳng chân ở nơi bác sĩ da liễu lấy sinh thiết để phân tích. Một thử nghiệm chính thức hơn, liên quan đến mRNA đặc hiệu cho khối u cho những người bị ung thư da, đã bắt đầu ngay sau đó.
Şahin và người vợ là nhà miễn dịch học của ông, Özlem Türeci, cũng bắt đầu nghiên cứu mRNA vào cuối những năm 1990, nhưng họ đợi lâu hơn Hoerr để thành lập công ty. Họ nghiên cứu công nghệ trong nhiều năm, làm việc tại Đại học Johannes Gutenberg Mainz ở Đức, kiếm bằng sáng chế, bài báo khoa học và tài trợ nghiên cứu, trước khi đưa ra một kế hoạch thương mại cho các nhà đầu tư tỷ phú vào năm 2007. “Nếu nó hoạt động, nó sẽ là bước đột phá,” Şahin nói. Ông đã nhận được 150 triệu euro tiền đầu tư.

Cùng năm đó, một công ty khởi nghiệp mRNA non trẻ có tên là RNARx nhận được một khoản tiền khiêm tốn hơn: 97.396 đô la tiền tài trợ dành cho doanh nghiệp nhỏ từ chính phủ Mỹ. Những người sáng lập công ty, nhà hóa sinh Katalin Karikó và nhà miễn dịch học Drew Weissman, cả hai khi đó làm việc tại Đại học Pennsylvania (UPenn) ở Philadelphia, đã đưa ra một phát hiện quan trọng mà ngày nay người ta cho rằng: việc thay đổi một phần của mã mRNA giúp mRNA tổng hợp vượt qua hàng phòng thủ miễn dịch bẩm sinh của tế bào.
Hiểu rõ nền tảng cơ bản
Karikó đã làm việc trong phòng thí nghiệm trong suốt những năm 1990 với mục tiêu biến mRNA thành một nền tảng thuốc, mặc dù các cơ quan tài trợ liên tục từ chối các đơn xin tài trợ của bà. Năm 1995, sau nhiều lần bị từ chối, bà được đưa ra lựa chọn rời bỏ UPenn hoặc chấp nhận cách chức và cắt lương. Bà đã chọn ở lại và tiếp tục theo đuổi lựa chọn của mình, cải tiến các quy trình của Malone và cố gắng để khiến các tế bào sản xuất một loại protein lớn và phức tạp có liên quan đến việc điều trị.

Năm 1997, bà bắt đầu làm việc với Weissman, người mới lập một phòng thí nghiệm tại UPenn. Họ cùng nhau lên kế hoạch phát triển một loại vắc-xin dựa trên mRNA cho HIV/AIDS. Nhưng mRNA của Karikó gây ra phản ứng viêm mạnh mẽ khi được tiêm vào chuột.
Bà và Weissman đã sớm tìm ra lý do: mRNA tổng hợp đã kích thích một loạt các cảm biến miễn dịch được gọi là các thụ thể Toll-like, hoạt động như những kẻ phản ứng đầu tiên đối với các tín hiệu nguy hiểm từ mầm bệnh. Vào năm 2005, họ này báo cáo rằng việc sắp xếp lại các liên kết hóa học trên một trong các nucleotide của mRNA, uridine, để tạo ra một chất tương tự gọi là pseudouridine, dường như ngăn cơ thể nhận diện mRNA như là kẻ thù.
Rất ít nhà khoa học vào thời điểm đó công nhận giá trị chữa bệnh của những nucleotide biến đổi này. Nhưng giới khoa học đã sớm thức tỉnh trước tiềm năng của chúng. Vào tháng 9 năm 2010, một nhóm nghiên cứu do Derrick Rossi, một nhà sinh học tế bào gốc tại Bệnh viện Nhi đồng Boston ở Massachusetts, đã mô tả cách mRNA đã sửa đổi có thể được sử dụng để biến đổi tế bào da, trước tiên thành tế bào gốc giống phôi thai và sau đó thành mô cơ. Phát hiện này đã gây ra một sự chú ý lớn. Rossi đã được giới thiệu trên tạp chí Time với tư cách là một trong những “người quan trọng” của năm 2010. Ông đồng sáng lập một công ty khởi nghiệp là Moderna ở Cambridge.
Moderna đã cố gắng đăng ký bằng sáng chế cho mRNA sửa đổi mà UPenn đã nộp vào năm 2006 cho phát minh của Karikó và Weissman. Nhưng đã quá trễ rồi. Sau khi không đạt được thỏa thuận cấp phép với RNARx, UPenn đã chọn thanh toán nhanh chóng. Vào tháng 2 năm 2010, nó đã mang lại độc quyền bằng sáng chế cho một nhà cung cấp hóa chất phòng thí nghiệm nhỏ ở Madison. Bây giờ được gọi là Cellscript, công ty đã trả 300.000 đô la trong thương vụ này. Nó sẽ tiếp tục thu về hàng trăm triệu đô la phí cấp phép phụ từ Moderna và BioNTech, những người sản xuất vắc-xin mRNA đầu tiên phòng COVID-19. Cả hai sản phẩm đều chứa mRNA đã được sửa đổi.
Trong khi đó, RNARx đã sử dụng hết 800.000 đô la tiền tài trợ dành cho doanh nghiệp nhỏ và ngừng hoạt động vào năm 2013, vào khoảng thời gian Karikó gia nhập BioNTech.
Cuộc tranh luận về pseudouridine
Các nhà nghiên cứu vẫn tranh cãi về việc liệu khám phá của Karikó và Weissman có cần thiết cho những vắc-xin mRNA thành công hay không. Moderna luôn sử dụng mRNA đã được sửa đổi – tên của công ty là từ ghép của hai từ sửa đổi (modify) và RNA. Nhưng một số người khác trong ngành thì không.
Các nhà nghiên cứu tại bộ phận trị liệu di truyền người của công ty dược phẩm Shire ở Lexington, Massachusetts, lý giải rằng mRNA không biến đổi có thể tạo ra một sản phẩm hiệu quả như vậy nếu cấu trúc ‘nắp’ phù hợp được thêm vào và tất cả các tạp chất được loại bỏ. Michael Heartlein, người dẫn đầu nỗ lực nghiên cứu của Shire và tiếp tục cải tiến công nghệ tại Translate Bio ở Cambridge, cho biết: “Nó phụ thuộc vào chất lượng của RNA”. Shire sau đó đã bán danh mục mRNA của mình cho Translate Bio. (Shire hiện là một phần của công ty Nhật Bản Takeda.)
Mặc dù Translate có một số dữ liệu về con người cho thấy mRNA của họ không gây ra đáp ứng miễn dịch đáng quan ngại, nhưng nền tảng của nó vẫn cần được chứng minh trên lâm sàng: ứng cử viên vắc-xin COVID-19 của họ vẫn đang trong quá trình thử nghiệm ban đầu trên người. Nhưng gã khổng lồ dược phẩm của Pháp Sanofi đã bị thuyết phục về lời hứa về công nghệ: vào tháng 8 năm 2021, họ công bố kế hoạch mua lại Translate với giá 3,2 tỷ đô la. (Heartlein rời đi vào năm ngoái để thành lập một công ty khác ở Waltham, Massachusetts, có tên là Maritime Therapeutics.)
Trong khi đó, CureVac có chiến lược giảm nhẹ miễn dịch của riêng mình, nó liên quan đến việc thay đổi trình tự di truyền của mRNA để giảm lượng uridine trong vắc-xin. Hai mươi năm nghiên cứu phương pháp đó dường như đã mang lại kết quả, với những thử nghiệm ban đầu đối với vắc-xin phòng bệnh dại và COVID-19 của công ty đều chứng tỏ thành công. Nhưng vào tháng 6, dữ liệu từ một thử nghiệm giai đoạn cuối cho thấy ứng cử viên vắc-xin coronavirus của CureVac có khả năng bảo vệ kém hơn nhiều so với vắc-xin của Moderna hoặc BioNTech.
Dựa trên những kết quả đó, một số chuyên gia mRNA hiện coi pseudouridine là một thành phần thiết yếu của công nghệ này – và do đó, họ cho rằng khám phá của Karikó và Weissman là một trong những đóng góp quan trọng xứng đáng nhận được sự công nhận và giải thưởng. Jake Becraft, đồng sáng lập và là giám đốc điều hành của Strand Therapeutics, một công ty sinh học tổng hợp có trụ sở tại Cambridge, đang nghiên cứu về phương pháp trị liệu dựa trên mRNA cho biết: “Người chiến thắng thực sự ở đây là RNA đã được sửa đổi.”
Không phải ai cũng chắc chắn như vậy. Bo Ying, giám đốc điều hành của Suzhou Abogen Biosciences, một công ty Trung Quốc sản xuất vắc-xin mRNA phòng COVID-19, cho biết: “Có nhiều yếu tố có thể ảnh hưởng đến độ an toàn và hiệu quả của vắc-xin mRNA, biến đổi hóa học của mRNA chỉ là một trong số đó.” Vắc-xin của công ty này đang được thử nghiệm lâm sàng giai đoạn cuối. (Được gọi là ARCoV, sản phẩm này sử dụng mRNA chưa được sửa đổi.)
Đột phá về chất béo
Đối với các công nghệ cốt yếu, nhiều chuyên gia nhấn mạnh một sự đổi mới khác rất quan trọng đối với vắc-xin mRNA – một cải tiến không liên quan gì đến mRNA. Đó là các giọt chất béo nhỏ được gọi là hạt nano lipid, hoặc LNP (lipid nanoparticle), bảo vệ mRNA và đưa nó vào tế bào.
Công nghệ này đến từ phòng thí nghiệm của Pieter Cullis, một nhà hóa sinh tại Đại học British Columbia ở Vancouver, Canada, và một số công ty do ông sáng lập hoặc lãnh đạo. Bắt đầu từ cuối những năm 1990, họ đã đi tiên phong trong các LNP để cung cấp các chuỗi axit nucleic giúp tắt hoạt động của gen. Một phương pháp điều trị như vậy, patisiran, hiện đã được chấp thuận để điều trị một căn bệnh di truyền hiếm gặp.
Sau khi liệu pháp làm tắt gen đó bắt đầu có triển vọng trong các thử nghiệm lâm sàng, vào năm 2012, hai trong số các công ty của Cullis đã bắt đầu khám phá các cơ hội cho hệ thống phân phối LNP trong các loại thuốc dựa trên mRNA. Ví dụ: Acuitas Therapeutics ở Vancouver, do giám đốc điều hành Thomas Madden dẫn đầu, đã tạo dựng quan hệ đối tác với nhóm của Weissman tại UPenn và với một số công ty mRNA để thử nghiệm các công thức mRNA-LNP khác nhau. Một trong những công thức này hiện có thể được tìm thấy trong vắc-xin COVID-19 của BioNTech và CureVac. Cách điều chế LNP của Moderna không khác nhiều.
Các hạt nano là một hỗn hợp của bốn phân tử chất béo: ba phân tử đóng góp vào cấu trúc và sự ổn định; phân tử thứ tư, được gọi là lipid có thể ion hóa, là chìa khóa cho sự thành công của LNP. Chất này được tích điện dương trong điều kiện phòng thí nghiệm, mang lại những ưu điểm tương tự như liposome mà Felgner đã phát triển và Malone đã thử nghiệm vào cuối những năm 1980. Nhưng các chất béo có thể ion hóa do Cullis và các đối tác thương mại của ông cải tiến sẽ chuyển đổi thành điện tích trung tính trong các điều kiện sinh lý như trong máu, giúp hạn chế tác động độc hại lên cơ thể.
Hơn nữa, loại cocktail 4 lipid cho phép sản phẩm được lưu trữ lâu hơn trên kệ thuốc và duy trì sự ổn định bên trong cơ thể, theo Ian MacLachlan, cựu giám đốc điều hành tại một số dự án liên kết với Cullis. Ông nói: “Đó là toàn bộ bộ dụng cụ dẫn đến dược lý học mà chúng tôi có hiện nay.”

Vào giữa những năm 2000, một phương pháp mới để trộn và sản xuất các hạt nano này đã được đưa ra. Nó liên quan đến việc sử dụng thiết bị ‘T-connector’, nó kết hợp chất béo (hòa tan trong cồn) với axit nucleic (hòa tan trong dung dịch đệm axit). Khi các dòng của hai dung dịch kết hợp với nhau, các thành phần tự phát hình thành các LNP được đóng gói dày đặc. Nó được chứng minh là một kỹ thuật đáng tin cậy hơn các cách khác để sản xuất thuốc dựa trên mRNA.
Andrew Geall, hiện là giám đốc phát triển của Replicate Bioscience ở San Diego, cho biết khi tất cả các mảnh ghép được ghép lại với nhau, “nó giống như một làn khói thánh, cuối cùng chúng tôi đã có một quy trình để có thể mở rộng quy mô sản xuất”. Geall dẫn đầu nhóm đầu tiên kết hợp LNP với một vắc-xin ARN, tại trung tâm Novartis của Mỹ ở Cambridge vào năm 2012. Mỗi công ty mRNA hiện sử dụng một số biến thể của nền tảng phân phối và hệ thống sản xuất LNP này – dù việc ai là người sở hữu bằng sáng chế liên quan vẫn là đối tượng của tranh chấp pháp lý. Chẳng hạn, Moderna bị kẹt trong cuộc chiến với một doanh nghiệp liên kết với Cullis – Arbutus Biopharma ở Vancouver – về việc ai là người nắm giữ quyền đối với công nghệ LNP có trong vắc-xin COVID-19 của Moderna.
Một ngành công nghiệp được sinh ra
Đến cuối những năm 2000, một số công ty dược phẩm lớn đã tham gia vào lĩnh vực mRNA. Ví dụ, vào năm 2008, cả Novartis và Shire đều thành lập đơn vị nghiên cứu mRNA – Novartis (do Geall lãnh đạo) tập trung vào vắc-xin, Shire (do Heartlein lãnh đạo) về điều trị. BioNTech đã ra mắt vào năm đó và các công ty khởi nghiệp khác nhanh chóng bước vào cuộc cạnh tranh, được hỗ trợ bởi một quyết định vào năm 2012 của Cơ quan Dự án Nghiên cứu Tiên tiến Quốc phòng Hoa Kỳ bắt đầu tài trợ cho các nhà nghiên cứu trong ngành để nghiên cứu vắc-xin và thuốc RNA. Moderna là một trong những công ty được xây dựng dựa trên công trình này và đến năm 2015, nó đã huy động được hơn 1 tỷ đô la với lời hứa khai thác mRNA để khiến các tế bào trong cơ thể tự sản xuất thuốc – từ đó sửa chữa các bệnh do thiếu hoặc bị lỗi protein. Khi kế hoạch đó thất bại, Moderna, do giám đốc điều hành Stéphane Bancel dẫn đầu, đã chọn ưu tiên cho một mục tiêu ít tham vọng hơn: sản xuất vắc-xin.

Điều đó ban đầu khiến nhiều nhà đầu tư và người quan sát thất vọng vì nền tảng vắc-xin dường như ít biến đổi và sinh lợi hơn. Vào đầu năm 2020, Moderna đã nâng cấp chín ứng cử viên vắc-xin mRNA cho các bệnh truyền nhiễm trên người để thử nghiệm. Không loại nào là một thành công dễ dàng. Chỉ một loại đã tiến tới giai đoạn thử nghiệm lớn hơn.
Nhưng khi COVID-19 xuất hiện, Moderna đã nhanh chóng hành động, tạo ra một loại vắc-xin nguyên mẫu trong vòng vài ngày kể từ khi trình tự bộ gen của virus được đưa ra trên mạng. Sau đó, công ty đã hợp tác với Viện Dị ứng và Bệnh truyền nhiễm Quốc gia Hoa Kỳ (NIAID) để tiến hành các nghiên cứu trên chuột và khởi động các thử nghiệm trên người, tất cả chỉ trong vòng chưa đầy mười tuần.
BioNTech cũng vậy, họ đã thực hiện một cách tiếp cận toàn diện. Vào tháng 3 năm 2020, công ty hợp tác với công ty dược phẩm Pfizer có trụ sở tại New York, và các thử nghiệm lâm sàng sau đó đã diễn ra với tốc độ kỷ lục, từ thử nghiệm đầu tiên trên người đến phê duyệt khẩn cấp trong vòng chưa đầy tám tháng.
Cả hai loại vắc-xin được phê duyệt đều sử dụng công thức mRNA đã được sửa đổi trong LNP. Cả hai cũng chứa các trình tự mã hóa một dạng của protein gai của SARS-CoV-2 có hình dạng phù hợp hơn để tạo ra khả năng miễn dịch bảo vệ. Nhiều chuyên gia nói rằng việc tinh chỉnh protein, do nhà nghiên cứu vắc-xin Barney Graham của NIAID và nhà sinh học cấu trúc Jason McLellan tại Đại học Texas ở Austin và Andrew Ward tại Scripps đưa ra, cũng là một đóng góp xứng đáng, mặc dù là một đóng góp dành riêng cho vắc-xin coronavirus, không phải cho việc tiêm chủng mRNA như một nền tảng chung.
Một số sự phẫn nộ trong các cuộc thảo luận về việc ghi nhận cho các khám phá mRNA liên quan đến việc ai là nắm giữ các bằng sáng chế sinh lợi. Nhưng phần lớn tài sản trí tuệ cơ bản bắt nguồn từ các tuyên bố được đưa ra vào năm 1989 bởi Felgner, Malone và các đồng nghiệp của họ tại Vical (và vào năm 1990 bởi Liljeström). Chúng chỉ có thời hạn 17 năm kể từ ngày phát hành và do đó hiện đã là tài sản công cộng.
Ngay cả bằng sáng chế của Karikó–Weissman, được cấp phép cho Cellscript và được nộp vào năm 2006, cũng sẽ hết hạn trong năm năm tới. Những người trong ngành cho biết điều này có nghĩa là sẽ sớm rất khó để cấp bằng sáng chế cho các tuyên bố rộng rãi về việc cung cấp mRNA trong các hạt nano lipid, mặc dù các công ty có thể cấp bằng sáng chế một cách hợp lý cho các trình tự cụ thể của mRNA – một dạng protein gai – hoặc các công thức lipid độc quyền.
Các hãng đang cố gắng. Moderna, kẻ thống trị trong lĩnh vực vắc-xin mRNA, với các vắc-xin thử nghiệm trong thử nghiệm lâm sàng đối với bệnh cúm, cytomegalovirus và một loạt các bệnh truyền nhiễm khác, đã nhận được hai bằng sáng chế vào năm ngoái về việc sử dụng rộng rãi mRNA để sản xuất các protein được tiết ra. Nhưng nhiều người trong ngành nói với Nature rằng họ nghĩ rằng những thứ này có thể thách thức được.
Eric Marcusson, giám đốc khoa học của Providence Therapeutics, một công ty vắc-xin mRNA ở Calgary, Canada, cho biết: “Chúng tôi không cảm thấy rằng có nhiều thứ có thể được cấp bằng sáng chế và chắc chắn là không thể có hiệu lực.
Cuộc tranh luận về giải Nobel
Về việc ai là người xứng đáng nhận giải Nobel, những cái tên thường được nhắc đến trong cuộc trò chuyện là Karikó và Weissman. Cả hai đã giành được một số giải thưởng, bao gồm một trong những Giải thưởng Đột phá (trị giá 3 triệu đô la, giải thưởng sinh lợi nhất trong giới khoa học) và Giải thưởng Princess of Asturias danh giá của Tây Ban Nha về Nghiên cứu Khoa học và Kỹ thuật. Cũng được công nhận trong giải thưởng Asturias còn có Felgner, Şahin, Türeci và Rossi, cùng với Sarah Gilbert, nhà nghiên cứu vắc-xin đứng sau vắc-xin COVID-19 do Đại học Oxford, Vương quốc Anh và công ty dược phẩm AstraZeneca phát triển, sử dụng vector virus thay vì mARN. (Giải thưởng duy nhất gần đây của Cullis là giải thưởng của người sáng lập trị giá 5.000 đô la từ Controlled Release Society, một tổ chức chuyên nghiệp của các nhà khoa học nghiên cứu các loại thuốc phóng thích chậm.)
Một số người cũng cho rằng Karikó nên được ghi nhận vì những đóng góp của bà cho cộng đồng nghiên cứu mRNA nói chung cũng như những khám phá của bà trong phòng thí nghiệm. Anna Blakney, một nhà kỹ thuật sinh học RNA tại Đại học British Columbia, cho biết: “Bà ấy không chỉ là một nhà khoa học đáng kinh ngạc, bà ấy còn là một động lực trong lĩnh vực này. Blakney ghi nhận Karikó khi cho bà một vị trí phát biểu tại một hội nghị lớn hai năm trước, khi bà vẫn còn ở vị trí postdoc mới (và trước khi Blakney đồng sáng lập VaxEquity, một công ty vắc-xin ở Cambridge, Vương quốc Anh, tập trung vào ông nghệ RNA tự nhân bản). Karikó “đang tích cực cố gắng nâng người khác lên trong thời điểm mà bà ấy chưa được công nhận trong toàn bộ sự nghiệp của mình”.
Mặc dù một số người tham gia vào sự phát triển của mRNA, bao gồm cả Malone, nghĩ rằng họ xứng đáng được công nhận nhiều hơn, những người khác sẵn sàng chia sẻ ánh đèn sân khấu. “Bạn thực sự không thể yêu cầu sự ghi nhận”, Cullis nói. Ví dụ, khi nói đến hệ thống phân phối lipid của mình, “chúng ta đang nói chuyện về hàng trăm, có thể là hàng nghìn người đã làm việc cùng nhau để tạo ra các hệ thống LNP này để chúng thực sự sẵn sàng khi thời điểm quan trọng tới”.
Karikó nói: “Mọi người chỉ dần dần thêm một thứ gì đó – kể cả tôi.”
Nhìn lại quá khứ, nhiều người nói rằng họ chỉ vui mừng vì vắc-xin mRNA đang tạo ra sự khác biệt cho nhân loại và họ có thể đã có đóng góp có giá trị trong suốt chặng đường đó. Felgner nói: “Tôi thật xúc động khi thấy điều này. Tất cả những điều mà chúng tôi nghĩ là sẽ xảy ra vào thời điểm đó – nó đang diễn ra ngay bây giờ.”
Nguồn: https://www.nature.com/articles/d41586-021-02483-w?utm_source=Nature+Briefing&utm_campaign=41794890cb-briefing-dy-20210914&utm_medium=email&utm_term=0_c9dfd39373-41794890cb-46564078




